Với giải bài tập Hóa 10 Bài 4: Mô hình nguyên tử và orbital nguyên tử sách Cánh diều hay nhất, chi tiết
giúp học sinh dễ dàng làm bài tập Hóa học 10 Bài 4.
Giải Hóa học 10 Cánh diều Bài 4: Mô hình nguyên tử và orbital nguyên tử
Video Giải Hóa học 10 Bài 4: Mô hình nguyên tử và orbital nguyên tử - Cô Phạm Huyền (Giáo viên VietJack)
Giải Hóa học 10 trang 21
Trong lịch sử các thuyết về mô hình nguyên tử, có mô hình hành tinh nguyên tử
Giải Hóa học 10 Bài 4: Mô hình nguyên tử và orbital nguyên tử
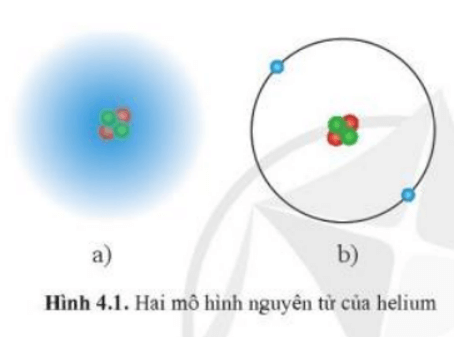
Mở đầu trang 21 Hóa học 10: Trong lịch sử các thuyết về mô hình nguyên tử, có mô hình hành tinh nguyên tử và mô hình hiện đại nguyên tử. Theo em, trong hai hình bên, hình nào thể hiện mô hình hành tinh nguyên tử, hình nào thể hiện mô hình hiện đại của nguyên tử?
Lời giải:
Hình a) thể hiện mô hình hiện đại của nguyên tử. Trong mô hình hiện đại của nguyên tử các electron chuyển động không theo quỹ đạo cố định. Electron chuyển động rất nhanh trong cả khu vực không gian xung quanh hạt nhân với xác xuất tìm thấy là khác nhau, sự chuyển động này tạo nên một hình ảnh giống như một đám mây electron.
Hình b) thể hiện mô hình hành tinh nguyên tử. Trong mô hình này các electron chuyển động theo quỹ đạo giống như các hành tinh quay xung quanh mặt trời.
Xem thêm lời giải bài tập Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Electron chuyển từ lớp gần hạt nhân ra lớp xa hạt nhân thì phải thu
Giải Hóa học 10 Bài 4: Mô hình nguyên tử và orbital nguyên tử
Câu hỏi 1 trang 21 Hóa học 10: Electron chuyển từ lớp gần hạt nhân ra lớp xa hạt nhân thì phải thu hay giải phóng năng lượng? Giải thích.
Lời giải:
Theo Rutherford – Bohr, electron ở càng xa hạt nhân thì có năng lượng càng cao.
⇒ Nếu electron chuyển từ lớp gần hạt nhân ra lớp xa hạt nhân thì phải thu năng lượng
Xem thêm lời giải bài tập Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Dựa theo mô hình nguyên tử của Rutherford – Bohr
Giải Hóa học 10 Bài 4: Mô hình nguyên tử và orbital nguyên tử
Luyện tập trang 22 Hóa học 10: Dựa theo mô hình nguyên tử của Rutherford – Bohr, hãy vẽ mô hình nguyên tử các nguyên tố có Z từ 1 đến 11.
Lời giải:
Mô hình nguyên tử các nguyên tố có Z từ 1 đến 11 theo mô hình nguyên tử của Rutherford – Bohr được biểu diễn như sau:
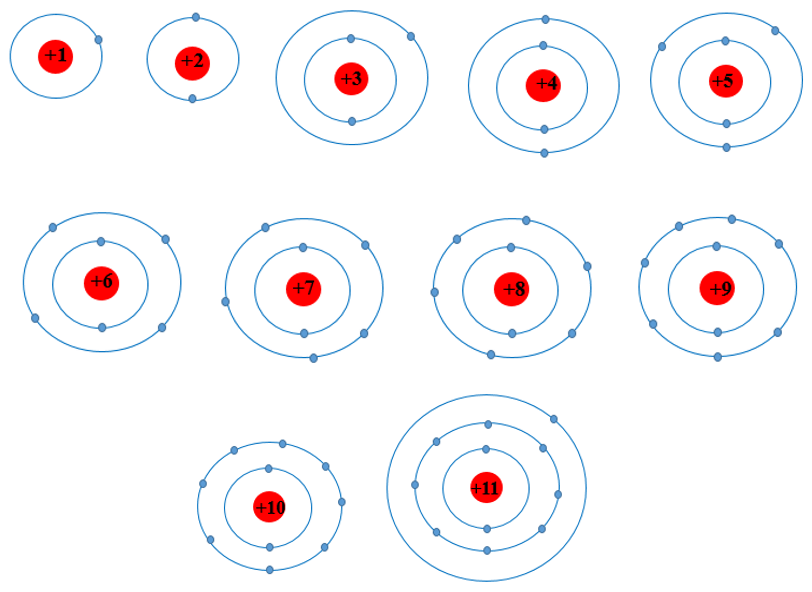
Xem thêm lời giải bài tập Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Theo em, xác suất tìm thấy electron trong toàn phần không gian bên ngoài đám mây
Giải Hóa học 10 Bài 4: Mô hình nguyên tử và orbital nguyên tử
Câu hỏi 2 trang 23 Hóa học 10: Theo em, xác suất tìm thấy electron trong toàn phần không gian bên ngoài đám mây là khoảng bao nhiêu phần trăm.
Lời giải:
Xác suất tìm thấy electron trong toàn phần không gian bên ngoài đám mây là khoảng 10%.
Xem thêm lời giải bài tập Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Khái niệm AO xuất phát từ mô hình Rutherford – Bohr hay mô hình hiện đại về nguyên tử?
Giải Hóa học 10 Bài 4: Mô hình nguyên tử và orbital nguyên tử
Câu hỏi 3 trang 23 Hóa học 10: Khái niệm AO xuất phát từ mô hình Rutherford – Bohr hay mô hình hiện đại về nguyên tử?
Lời giải:
Khái niệm AO (orbital nguyên tử) xuất phát từ mô hình hiện đại về nguyên tử.
Xem thêm lời giải bài tập Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Chọn phát biểu đúng về electron s
Giải Hóa học 10 Bài 4: Mô hình nguyên tử và orbital nguyên tử
Câu hỏi 4 trang 23 Hóa học 10: Chọn phát biểu đúng về electron s.
A. Là electron chuyển động chủ yếu trong khu vực không gian hình cầu.
B. Là electron chỉ chuyển động trên một mặt cầu.
C. Là electron chỉ chuyển động trên một đường tròn.
Lời giải:
Đáp án đúng là: A
Electron s là electron chuyển động chủ yếu trong khu vực không gian hình cầu.
Xem thêm lời giải bài tập Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Những phát biểu nào sau đây là đúng khi nói về mô hình Rutherford – Bohr?
Giải Hóa học 10 Bài 4: Mô hình nguyên tử và orbital nguyên tử
Bài 1 trang 25 Hóa học 10: Những phát biểu nào sau đây là đúng khi nói về mô hình Rutherford – Bohr?
(a) Electron quay xung quanh hạt nhân theo các quỹ đạo giống như các hành tinh quay xung quanh Mặt Trời.
(b) Electron không chuyển động theo quỹ đạo cố định mà trong cả khu vực không gian xung quanh hạt nhân.
(c) Electron không bị hút vào hạt nhân do còn chịu tác dụng của lực quán tính li tâm.
Lời giải:
Phát biểu (a) và (c) đúng
Theo mô hình Rutherford – Bohr:
Electron quay xung quanh hạt nhân theo các quỹ đạo giống như các hành tinh quay xung quanh Mặt Trời.
Các electron dù mang điện tích âm nhưng không thể bị hút vào hạt nhân bởi lực hút này cân bằng với lực quán tính li tâm tác dụng lên electron (kéo electron ra xa hạt nhân).
Xem thêm lời giải bài tập Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Nguyên tử Li (Z = 3) có 2 electron ở lớp K và 1 electron ở lớp L
Giải Hóa học 10 Bài 4: Mô hình nguyên tử và orbital nguyên tử
Bài 2 trang 25 Hóa học 10: Nguyên tử Li (Z = 3) có 2 electron ở lớp K và 1 electron ở lớp L. So sánh năng lượng của electron giữa hai lớp theo mô hình Rutherford – Bohr.
Lời giải:
Theo mô hình Rutherford – Bohr: Electron ở càng xa hạt nhân thì có năng lượng càng cao.
⇒ Lớp L ở xa hạt nhân hơn nên electron ở lớp L có năng lượng cao hơn.
Xem thêm lời giải bài tập Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Sử dụng mô hình Rutherford – Bohr, hãy cho biết khi electron của nguyên tử H hấp thụ
Giải Hóa học 10 Bài 4: Mô hình nguyên tử và orbital nguyên tử
Bài 3 trang 25 Hóa học 10: Sử dụng mô hình Rutherford – Bohr, hãy cho biết khi electron của nguyên tử H hấp thụ một năng lượng phù hợp, electron đó sẽ chuyển ra xa hay tiến lại gần hạt nhân hơn. Giải thích.
Lời giải:
Theo mô hình Rutherford – Bohr Electron ở càng xa hạt nhân thì có năng lượng càng cao.
Vì thế nên khi electron của nguyên tử H hấp thụ một năng lượng phù hợp, electron đó sẽ chuyển ra xa hạt nhân hơn.
Xem thêm lời giải bài tập Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Từ khái niệm Orbital nguyên tử là khu vực không gian xung quanh hạt nhân nguyên tử
Giải Hóa học 10 Bài 4: Mô hình nguyên tử và orbital nguyên tử
Bài 4 trang 25 Hóa học 10: Từ khái niệm “Orbital nguyên tử là khu vực không gian xung quanh hạt nhân nguyên tử mà xác suất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%)” hãy cho biết phát biểu “Xác suất tìm thấy electron tại mỗi điểm trong không gian của AO là 90%”. có đúng không. Giải thích.
Lời giải:
Phát biểu: “Xác suất tìm thấy electron tại mỗi điểm trong không gian của AO là 90%” chưa chính xác.
Giải thích:
Trong nguyên tử, các electron chuyển động rất nhanh xung quanh hạt nhân không theo quỹ đạo nào. Giả sử, ta có thể chụp ảnh một electron ở một thời điểm nào đó, nếu chúng ta lại chụp ảnh tại một thời điểm tiếp theo thì electron sẽ ở vị trị khác. Do đó xác suất tìm thấy electron tại mỗi điểm trong không gian của AO không thể là 90%.
Xem thêm lời giải bài tập Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Trả lời những câu hỏi sau đây liên quan đến mô hình Rutherford – Bohr
Giải Hóa học 10 Bài 4: Mô hình nguyên tử và orbital nguyên tử
Bài 5 trang 25 Hóa học 10: Trả lời những câu hỏi sau đây liên quan đến mô hình Rutherford – Bohr và mô hình hiện đại về nguyên tử.
a) Vì sao còn gọi mô hình Rutherford – Bohr là mô hình hành tinh nguyên tử?
b) Theo mô hình hiện đại, orbital p có hình số 8 nổi với hai phần (còn gọi là hai thùy) giống hệt nhau. Xác suất tìm thấy electron ở mỗi thùy là khoảng bao nhiêu phần trăm?
c) So sánh sự giống và khác nhau giữa mô hình Rutherford – Bohr và mô hình hiện đại về nguyên tử.
Lời giải:
a) Mô hình Rutherford – Bohr còn gọi là mô hình hành tinh nguyên tử vì trong mô hình Rutherford – Bohr electron quay xung quanh hạt nhân theo các quỹ đạo giống như các hành tinh quay xung quanh Mặt Trời.
b) Theo mô hình hiện đại, xác suất tìm thấy electron ở mỗi thùy trong AO p là khoảng 90%.
c)

Xem thêm lời giải bài tập Hóa học lớp 10 Cánh diều hay, chi tiết khác:


