Hóa 10 Chân trời sáng tạo Bài 9: Liên kết ion
Giải Hóa học 10 | No tags
Mục lục
- Đang tải mục lục...
Hơn 50% dược phẩm sử dụng trong y tế được sản xuất dưới dạng muối
Giải Hóa 10 Bài 9: Liên kết ion
Câu hỏi 1 trang 55 Hóa học 10: Hơn 50% dược phẩm sử dụng trong y tế được sản xuất dưới dạng muối với mục đích thúc đẩy sự hấp thu các dược chất vào máu, tăng cường hiệu quả điều trị. Trong đó, thường gặp nhất là các muối hydrochloride, sodium hoặc sulfate.
Muối thường là các hợp chất chứa liên kết ion. Liên kết ion là gì?
Lời giải:
Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Xem thêm lời giải bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
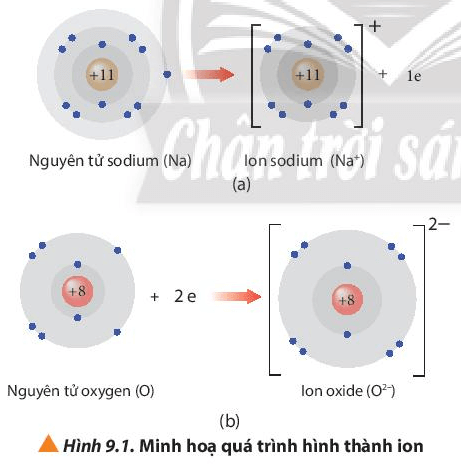
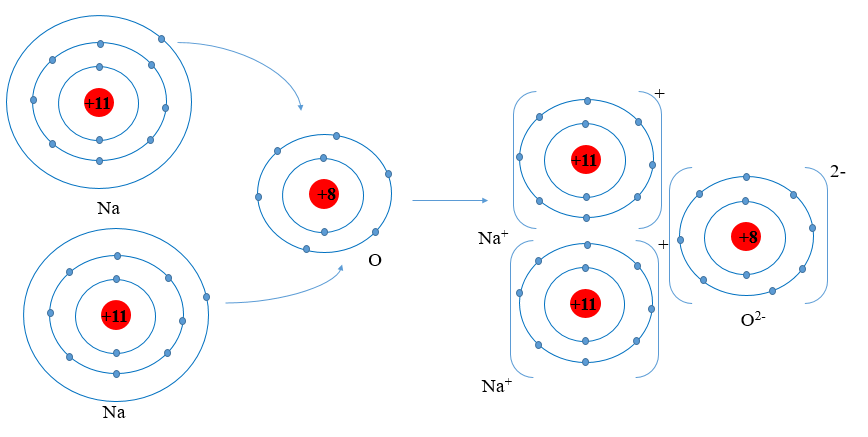
Quan sát Hình 9.1, nhận xét số electron trên lớp vỏ với số proton
Giải Hóa 10 Bài 9: Liên kết ion
Câu hỏi 1 trang 55 Hóa học 10: Quan sát Hình 9.1, nhận xét số electron trên lớp vỏ với số proton trong hạt nhân của mỗi ion tạo thành
Lời giải:
- Ion sodium: có 10 electron ở lớp vỏ ít hơn số proton trong hạt nhân là 11 proton.
- Ion oxide: có 10 electron ở lớp vỏ nhiều hơn số proton trong hạt nhân là 8 proton.
Xem thêm lời giải bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Trình bày cách tính điện tích của các ion thu được khi nguyên tử nhường hoặc nhận
Giải Hóa 10 Bài 9: Liên kết ion
Câu hỏi 2 trang 55 Hóa học 10: Trình bày cách tính điện tích của các ion thu được khi nguyên tử nhường hoặc nhận thêm electron trong Hình 9.1
Lời giải:
Cách tích điện tích của ion thu được khi nguyên tử nhường hoặc nhận thêm electron:
Điện tích ion = số đơn vị điện tích hạt nhân – số electron của ion
- Ví dụ:
+ Ion sodium: điện tích = 11 – 10 = 1 ⇒ Điện tích là +1
+ Ion oxide: điện tích = 8 – 10 = -2 ⇒ Điện tích là -2
Xem thêm lời giải bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Ion Na+ và ion O2- thu được có bền vững về mặt hóa học không?
Giải Hóa 10 Bài 9: Liên kết ion
Câu hỏi 3 trang 55 Hóa học 10: Ion Na+ và ion O2- thu được có bền vững về mặt hóa học không? Chúng có cấu hình electron giống cấu hình electron nguyên tử của nguyên tố nào?
Lời giải:
- Ion Na+ có 10 electron ở lớp vỏ và có 2 lớp electron ⇒ Giống cấu hình electron nguyên tử của nguyên tố Ne ⇒ Bền vững về mặt hóa học.
- Ion O2- có 10 electron ở lớp vỏ và có 2 lớp electron ⇒ Giống cấu hình electron nguyên tử của nguyên tố Ne ⇒ Bền vững về mặt hóa học.
Xem thêm lời giải bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Trong các nguyên tố kim loại và phi kim, nguyên tử của những nguyên tố nào
Giải Hóa 10 Bài 9: Liên kết ion
Câu hỏi 4 trang 56 Hóa học 10: Trong các nguyên tố kim loại và phi kim, nguyên tử của những nguyên tố nào có xu hướng tạo thành cation hoặc anion? Giải thích
Lời giải:
- Các nguyên tố kim loại dễ nhường electron ⇒ Tạo thành cation.
- Các nguyên tố phi kim dễ nhận electron ⇒ Tạo thành anion.
Xem thêm lời giải bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
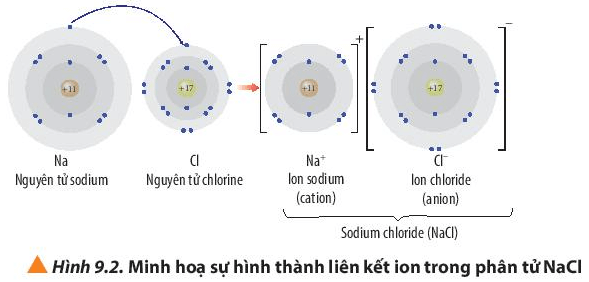
Quan sát Hình 9.2, hãy trình bày sự hình thành liên kết ion trong phân tử NaCl
Giải Hóa 10 Bài 9: Liên kết ion
Câu hỏi 5 trang 56 Hóa học 10: Quan sát Hình 9.2, hãy trình bày sự hình thành liên kết ion trong phân tử NaCl khi sodium tác dụng với chlorine
Lời giải:
+ Nguyên tử Na (Z = 11) nhường đi 1 electron ở lớp ngoài cùng trở thành ion mang điện tích dương, kí hiệu là Na+.
+ Nguyên tử Cl (Z = 17) nhận 1 electron từ nguyên tử Na trở thành ion mang điện tích âm, kí hiệu là Cl-.
Các ion Na+ và Cl- hút nhau tạo thành liên kết trong phân tử NaCl.
Phương trình hóa học: 2Na + Cl2 → 2NaCl.
Xem thêm lời giải bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Các ion Na+ và Cl- có cấu hình electron nguyên tử của các khí hiếm tương ứng nào?
Giải Hóa 10 Bài 9: Liên kết ion
Câu hỏi 6 trang 56 Hóa học 10: Các ion Na+ và Cl- có cấu hình electron nguyên tử của các khí hiếm tương ứng nào?
Lời giải:
- Ion Na+ có 10 electron ở lớp vỏ, lớp ngoài cùng có 8 electron và có 2 lớp electron
⇒ Giống cấu hình electron của khí hiếm Ne: 1s22s22p6
- Ion Cl- có 18 electron ở lớp vỏ và có 3 lớp electron
⇒ Giống cấu hình electron của khí hiếm Ar: 1s22s22p63s23p6
Xem thêm lời giải bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
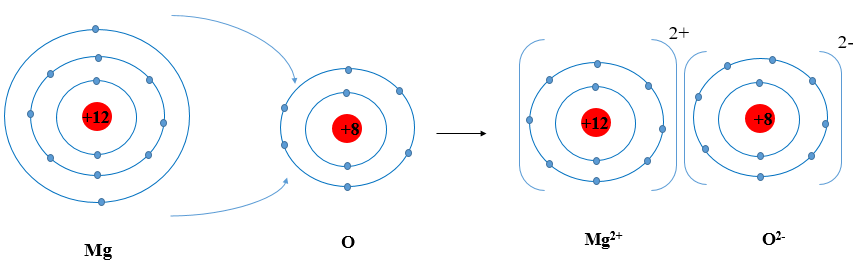
Trình bày sự hình thành liên kết ion trong phân tử MgO
Giải Hóa 10 Bài 9: Liên kết ion
Luyện tập trang 56 Hóa học 10: Trình bày sự hình thành liên kết ion trong phân tử MgO khi magnesium tác dụng với oxygen.
Lời giải:
- Nguyên tử Mg (Z = 12): 1s22s22p63s2 ⇒ Có 2 electron ở lớp ngoài cùng.
⇒ Có xu hướng nhường 2 electron để đạt cấu hình electron của khí hiếm tạo thành ion Mg2+
- Nguyên tử O (Z = 8): 1s22s22p4 ⇒ Có 6 electron ở lớp ngoài cùng.
⇒ Có xu hướng nhận 2 electron để đạt cấu hình electron của khí hiếm tạo thành ion O2-
⇒ Nguyên tử O sẽ nhận 2 electron của nguyên tử Mg tạo thành ion O2-.
- Hai ion là Mg2+ và O2- liên kết với nhau tạo thành phân tử MgO
Xem thêm lời giải bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Quan sát Hình 9.3, cho biết: Tinh thể NaCl có cấu trúc của hình khối nào
Giải Hóa 10 Bài 9: Liên kết ion
Câu hỏi 7 trang 56 Hóa học 10: Quan sát Hình 9.3, cho biết:
a) Tinh thể NaCl có cấu trúc của hình khối nào.
b) Các ion Na+ và Cl- phân bố trong tinh thể như thế nào
c) Xung quanh mỗi loại ion có bao nhiêu ion ngược dấu gần nhất
Lời giải:
a) Tinh thể NaCl có cấu trúc là hình lập phương.
b) Các ion Na+ và Cl- được xếp xen kẽ nhau đều đặn trên các đỉnh của hình lập phương.
c) Xung quanh mỗi loại ion có 6 ion ngược dấu gần nhất.
Ví dụ: xung quanh ion Na+ có 6 ion Cl-
Xem thêm lời giải bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Em hiểu thế nào về tinh thể ion?
Giải Hóa 10 Bài 9: Liên kết ion
Câu hỏi 8 trang 56 Hóa học 10: Em hiểu thế nào về tinh thể ion?
Lời giải:
Tinh thể ion là hợp chất ion ở dạng rắn. Chúng gồm các ion liên kết với nhau bằng lực hút tĩnh điện tạo thành một mạng tinh thể.
Xem thêm lời giải bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
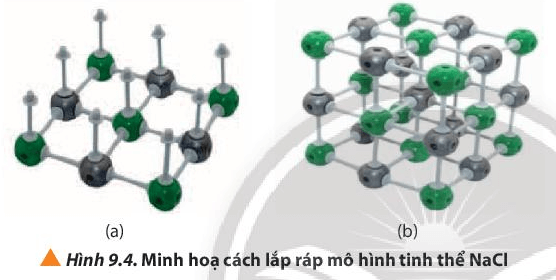
Quan sát các bước trong Hình 9.4, cho biết cần bao nhiêu thanh nối
Giải Hóa 10 Bài 9: Liên kết ion
Câu hỏi 9 trang 57 Hóa học 10: Quan sát các bước trong Hình 9.4, cho biết cần bao nhiêu thanh nối và khối cầu mỗi loại để lắp ráp thành mô hình một ô mạng tinh thể NaCl.
Lời giải:
Cần 12 thanh nối cho một lớp của tinh thể hình lập phương.
Tinh thể gồm 3 lớp ⇒ 12.3 = 36 thanh nối
3 lớp này được ghép với nhau bằng các thanh nối thẳng đứng ⇒ Gồm 9.2 = 18 thanh nối
Tổng cộng cần: 36 + 18 = 54 thanh nối
Xem thêm lời giải bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Ion Na+ đóng vai trò rất quan trọng trong việc điều hòa huyết áp của cơ thể
Giải Hóa 10 Bài 9: Liên kết ion
Vận dụng trang 57 Hóa học 10: Ion Na+ đóng vai trò rất quan trọng trong việc điều hòa huyết áp của cơ thể. Tuy nhiên, nếu cơ thể hấp thụ một lượng lớn ion này sẽ dẫn đến các vấn đề về tim mạch và thận. Các nhà khoa học khuyến cáo lượng ion Na+ nạp vào cơ thể nên thấp hơn 2300 mg, nhưng không ít hơn 500 mg mỗi ngày đối với một người lớn để đảm bảo sức khỏe.
Giả sử, nếu một người sử dụng 5,0 g muối ăn mỗi ngày thì lượng ion Na+ mà người ấy nạp vào cơ thể có vượt mức giới hạn cho phép không?
Lời giải:
Lượng ion Na+ mà người này nạp vào cơ thể là: = 1,966 gam = 1966 mg
Ta có: 500 < 1966 < 2300
⇒ nếu một người sử dụng 5,0 g muối ăn mỗi ngày thì lượng ion Na+ mà người ấy nạp vào cơ thể không vượt mức giới hạn cho phép.
Xem thêm lời giải bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Ion Mg2+ có cấu hình electron giống cấu hình electron của khí hiếm nào?
Giải Hóa 10 Bài 9: Liên kết ion
Bài 1 trang 58 Hóa học 10: Ion Mg2+ có cấu hình electron giống cấu hình electron của khí hiếm nào?
A. Helium
B. Neon
C. Argon
D. Krypton
Lời giải:
Đáp án đúng là: B
Cấu hình electron của nguyên tử Mg (Z = 12): 1s22s22p63s2
Nguyên tử Mg nhường 2 electron tạo thành ion Mg2+ có cấu hình electron là:
1s22s22p6 giống với cấu hình electron của khí hiếm neon.
Xem thêm lời giải bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Cho các ion sau: Ca2+, F-, Al3+ và N3- Số ion có cấu hình electron của khí hiếm
Giải Hóa 10 Bài 9: Liên kết ion
Bài 2 trang 58 Hóa học 10: Cho các ion sau: Ca2+, F-, Al3+ và N3-. Số ion có cấu hình electron của khí hiếm neon là
A. 4
B. 2
C. 1
D. 3
Lời giải:
Đáp án đúng là: D
- Cấu hình electron của nguyên tử Ca (Z = 20): 1s22s22p63s23p64s2
Nguyên tử Ca nhường 2 electron tạo thành ion Ca2+ có cấu hình electron là:
1s22s22p6 3s23p6 giống với cấu hình electron của khí hiếm Ar.
- Cấu hình electron của nguyên tử F (Z = 9): 1s22s22p5
Nguyên tử F nhận 1 electron tạo thành ion F- có cấu hình electron là:
1s22s22p6 giống với cấu hình electron của khí hiếm neon.
- Cấu hình electron của nguyên tử Al (Z = 13): 1s22s22p63s23p1
Nguyên tử Al nhường 3 electron tạo thành ion Al3+ có cấu hình electron là:
1s22s22p6 giống với cấu hình electron của khí hiếm neon.
- Cấu hình electron của nguyên tử N (Z = 7): 1s22s22p3
Nguyên tử N nhận 3 electron tạo thành ion N3- có cấu hình electron là:
1s22s22p6 giống với cấu hình electron của khí hiếm neon.
Vậy có 3 ion là F-, Al3+ và N3- có cấu hình electron giống với cấu hình electron của khí hiếm Ne.
Xem thêm lời giải bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Potassium và magnesium là các nguyên tố thiết yếu đối với cơ thể sinh vật sống
Giải Hóa 10 Bài 9: Liên kết ion
Bài 3 trang 58 Hóa học 10: Potassium và magnesium là các nguyên tố thiết yếu đối với cơ thể sinh vật sống.
a) Viết cấu hình electron của các ion được tạo thành từ nguyên tử của các nguyên tố này. Chúng có cấu hình electron của những nguyên tử khí hiếm nào?
b) Có hợp chất ion nào chỉ tạo bởi các ion trên với nhau không? Vì sao?
Lời giải:
a) – Potassium (K, Z = 19) có cấu hình electron là: 1s22s22p63s23p64s1
Nguyên tử K nhường 1 electron tạo thành ion K+ có cấu hình electron là: 1s22s22p63s23p6 giống với cấu hình electron của khí hiếm Ar.
- Cấu hình electron của nguyên tử Mg (Z = 12): 1s22s22p63s2
Nguyên tử Mg nhường 2 electron tạo thành ion Mg2+ có cấu hình electron là:
1s22s22p6 giống với cấu hình electron của khí hiếm neon.
b) Không có hợp chất ion nào chỉ tạo bởi các ion K+ và Mg2+ với nhau vì hai ion này cùng mang điện tích dương. Hợp chất ion chỉ được tạo bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Xem thêm lời giải bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Hoàn thành những thông tin còn thiếu trong bảng sau
Giải Hóa 10 Bài 9: Liên kết ion
Bài 4 trang 58 Hóa học 10: Hoàn thành những thông tin còn thiếu trong bảng sau:
|
Công thức hợp chất ion |
Cation |
Anion |
|
CaF2 |
? |
? |
|
? |
K+ |
O2- |
Lời giải:
|
Công thức hợp chất ion |
Cation |
Anion |
|
CaF2 |
Ca2+ |
F- |
|
K2O |
K+ |
O2- |
Xem thêm lời giải bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Sodium oxide (Na2O) có trong thành phần thủy tinh và các sản phẩm gốm sứ
Giải Hóa 10 Bài 9: Liên kết ion
Bài 5 trang 58 Hóa học 10: Sodium oxide (Na2O) có trong thành phần thủy tinh và các sản phẩm gốm sứ. Trình bày sự hình thành liên kết ion trong phân tử sodium oxide.
Lời giải:
- Nguyên tử Na (Z = 11): 1s22s22p63s1 ⇒ Có 1 electron ở lớp ngoài cùng
⇒ Có xu hướng nhường 1 electron để đạt cấu hình electron của khí hiếm tạo thành ion Na+
- Nguyên tử O (Z = 8): 1s22s22p4 ⇒ Có 6 electron ở lớp ngoài cùng
⇒ Có xu hướng nhận 2 electron để đạt cấu hình electron của khí hiếm tạo thành ion O2-
⇒ Nguyên tử O nhận 2 electron của hai nguyên tử Na tạo thành ion là O2-.
- Hai ion Na+ và 1 ion O2- liên kết với nhau tạo thành phân tử Na2O.
Xem thêm lời giải bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác: